Fino agli anni 60 la membrana plasmatica appariva come un semplice involucro semipermeabile, che racchiudeva il contenuto del citoplasma, di spessore talmente sottile da non essere visibile al microscopio ottico.
La rivoluzione nello studio della biologia cellulare che ha caratterizzato questi ultimi 20 anni ha portato ad uno sconvolgimento nei dogmi della biologia tanto che si sta arrivando alla conclusione che il “segreto della vita” non sta nella celeberrima doppia elica del DNA ma nella comprensione dei “meccanismi biologici” che stanno alla base delle molteplici funzioni della membrana cellulare.
Il ruolo della membrana cellulare sta iniziando ad assumere un ruolo sempre più preponderante, uguale se non superiore a quello degli acidi nucleici con funzioni che vanno al di là del suo ruolo di separazione dell’ambiente cellulare interno dall’esterno e permettono alla cellula di interagire con l’ambiente orientando il suo comportamento.
Mentre le cellule enucleate rimangono vitali e continuano comunque a coordinare alcune funzioni fisiologiche (respirazione – digestione – motilità) e conservano la capacità di comunicare con altre cellule, la distruzione della membrana cellulare porta ad una morte cellulare istantanea.
Il “cervello” della cellula quindi sembrerebbe risiedere non tanto nel suo DNA, sicuramente responsabile della sua capacità riproduttiva, ma più probabilmente nella membrana plasmatica i cui complessi proteici sembrano alla base della intelligenza cellulare. Infatti, se distruggiamo le proteine recettore di una cellula, essa, come il cervello, entra in uno stato “comatoso” nel quale non riesce a ricevere i segnali ambientali fondamentali per la sua attività.
Le membrane biologiche sono fatte soprattutto di fosolipidi, grassi con una struttura complessa contenenti fosforo. Questi componenti sono alla base di una delle sue principali funzioni, quella di “barriera idrofobica semipermanente” che determina una diversa concentrazione di ioni e sostanze chimiche tra ambiente intracellulare.
Per meglio comprendere la funzione dei fosfolipidi e la loro funzione possiamo pensare come a un aquilone con due lunghe code. La testa dell’aquilone rappresenta la parte del “idrofila” del fosfolipide a cui piace essere a contatto con l’acqua, un po’ come la testa dell’aquilone che va incontro al vento. Le code dei fosfolipidi, formate da catene di acidi grassi e lipidi, sono “idrofobe”, insolubili in acqua . Esse restano indietro alle teste così come le code dell’aquilone sono respinte dal vento e preferiscono stare in una ambiente che corrisponde alla loro struttura, sono cioè lipofiliche.
Sulla superficie della membrana i fosfolipidi, “aquiloni” si dispongono lungo un doppio strato con disposizione testa coda- coda testa in modo tale che le teste interagiscono attraverso legami elettrostatici con l’ambiente acquoso sia nello spazio intra che extra cellulare, mentre le code interagiscono tra di loro verso l’interno. Nella componente lipidica della membrana si vanno a collocare proteine intrinseche ed estrinseche, con importanti funzioni fisiologiche.
E’ attraverso questa sua struttura che la membrana cellulare espleta la funzione di “membrana idrofobica semipermanente”, determinando una diversa concentrazione di ioni e sostanze chimiche tra ambiente intra ed extracellulare. Inoltre essa permette l’ingresso di molecole nutritive attraverso i “sistemi di trasporto”; impedisce l’ingresso di molecole tossiche e microrganismi; consente l’eliminazione di elementi di scarto; svolge un ruolo chiave nelle comunicazioni intracellulari attraverso “siti recettoriali” ed interviene nella trasduzione di segnali all’interno della cellula tramite “sistemi enzimatici”.
La membrana del globulo rosso (eritrocita) costituisce pertanto un valido esempio per studiare ed approfondire tutte queste funzionalità.
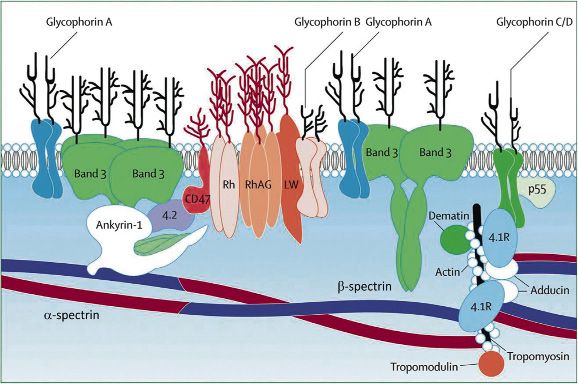
Le proteine della membrana eritrocitaria possono essere divise in due gruppi principali: proteine di membrana integrali e periferiche.
Le proteine integrali rappresentano la componente maggiore del “bilayer fosfolipidico” e tra di esse rivestono una particolare importanza la “proteina della banda 3” e le “glicoforine”. Il dominio extracellulare di queste proteine è glicosilato ed esso è il responsabile della componente antigenica che rappresenta i gruppi sanguigni.
Le glicoforine sono delle proteine transmenbrana che giocano un ruolo fondamentale nel permettere l’attacco del citoscheletro alla membrana cellulare. Tra queste la glicoforina A, prima proteina di membrana di cui sia stata determinata la sequenza amminoacidica, mediante la sua elevata concentrazione di cariche negative portate dall’acido sialico, consente agli eritrociti di respingersi l’un l’altro. Questa caratteristica impedisce agli eritrociti di ammassarsi quando circolano nei vasi più sottili del circolo sanguigno. Tuttavia, l’importanza di questa proteina è legata anche ad un altro aspetto. Gli individui i cui eritrociti mostrano scarsa “glicoforina A” sono protetti dal contrarre la Malaria. La proteina infatti è anche il recettore del plasmodio della malaria, il quale utilizza il legame con questa proteina per essere veicolato all’interno dell’eritrocita.
Come intuibile, la “proteina della banda 3” prende il nome dalla sua mobilità elettroforetica. Il suo ruolo è quello di fungere da canale passivo per lo scambio di anioni attraverso la membrana. Inoltre le proteine della banda 3 hanno la funzione di legare l’emoglobina e agire come ulteriore sito di ancoraggio per il citoscheletro.
Le proteine periferiche di membrana comprendono molte proteine citoscheletriche come l’actina e le proteine della banda 4.1 e 4.9 e la tropomiosina. Esse mantengono la forma biconcava dell’eritrocita e controllano i movimenti delle proteine integrali di membrana. L’ancoraggio della struttura citoscheletrica alla membrana dell’eritrocita avviene attraverso una proteina chiamata Ankyrina.
Il “reticolo spettrina-actina” conferisce resistenza, elasticità e flessibilità agli eritrociti, i quali circolano in vasi spesso molto stretti e sono sottoposti a forze tangenziali che tendono a lacerarli.
Mutazioni che coinvolgono la spettrina comunemente causano difetti ereditari dell’eritrocita, tra cui ellissocitosi ereditaria e sferocitosi ereditaria.
Il colesterolo è situato nella parte centrale del doppio strato, soprattutto in aggregati, i cosiddetti “lipid rafts”, ed è destinato a cooperare nel conservare la struttura e la deformabilità della membrana. Lo strato proteico più interno è formato da enzimi e proteine carrier per gli elettroliti e i metaboliti. Questa è la configurazione chimica che dà stabilità all’eritrocita e ne impedisce la rimozione dalla circolazione. Se per qualsiasi motivo i fosfolipidi dello strato interno si esteriorizzano, l’eritrocita non è più riconosciuto come “sano” dal sistema ed è eliminato per fagocitosi prevalentemente nella milza. La componente proteica è quella che fornisce gli enzimi per il trasporto di metaboliti e gli antigeni dei gruppi sanguigni.
Non solo la membrana dell’eritrocita è una delle più conosciute in termini di struttura e funzione, ma da sempre essa è stata studiata anche in relazione ai disordini genetici correlati. La maggior parte delle proteine di membrana dell’eritrocita sono state studiate in grande dettaglio e anche i geni responsabili delle patologie di membrana correlate sono ad oggi noti. I disordini legati a difetti della membrana dell’eritrocita comprendono un gruppo piuttosto eterogeneo di patologie ereditarie legate ad alterazioni a carico di varie proteine di membrana o del citoscheletro dell’eritrocita, con conseguente diminuzione della deformabilità eritrocitaria, ridotta emivita e prematura rimozione degli eritrociti dal circolo. Tale gruppo di disordini include: sferocitosi ereditaria (HS), ellissocitosi ereditaria (HE), piropoichilocitosi ereditaria (HPP), ovalocitosi del sud-est asiatico (SAO), stomatocitosi ereditaria deidrata (DHSt) ed overidrata (OHSt), pseudoiperkalemia familiare (FP), crioidrocitosi ereditaria (CHC).